| Bohri | |||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
107Bh
| |||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||
| Aspecte | |||||||||||||||||||||||||||||||||||||||||||
| Desconegut | |||||||||||||||||||||||||||||||||||||||||||
| Propietats generals | |||||||||||||||||||||||||||||||||||||||||||
| Nom, símbol, nombre | Bohri, Bh, 107 | ||||||||||||||||||||||||||||||||||||||||||
| Categoria d'elements | Metalls de transició | ||||||||||||||||||||||||||||||||||||||||||
| Grup, període, bloc | 7, 7, d | ||||||||||||||||||||||||||||||||||||||||||
| Pes atòmic estàndard | [270] | ||||||||||||||||||||||||||||||||||||||||||
| Configuració electrònica | [Rn] 5f14 6d5 7s2 (calculat)[1][2] 2, 8, 18, 32, 32, 13, 2 (predit) 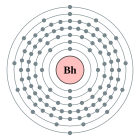
| ||||||||||||||||||||||||||||||||||||||||||
| Propietats físiques | |||||||||||||||||||||||||||||||||||||||||||
| Fase | Sòlid (predit[3]) | ||||||||||||||||||||||||||||||||||||||||||
| Densitat (prop de la t. a.) |
37,1 (predit)[2][4] g·cm−3 | ||||||||||||||||||||||||||||||||||||||||||
| Propietats atòmiques | |||||||||||||||||||||||||||||||||||||||||||
| Estats d'oxidació | 7, 5, 4, 3 (predit)[2] (només els estats d'oxidació en negreta es coneixen experimentalment) | ||||||||||||||||||||||||||||||||||||||||||
| Energies d'ionització (més) |
1a: 742,9 (estimat)[2] kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||
| 2a: 1.688,5 (estimat)[2] kJ·mol−1 | |||||||||||||||||||||||||||||||||||||||||||
| 3a: 2.566,5 (estimat)[2] kJ·mol−1 | |||||||||||||||||||||||||||||||||||||||||||
| Radi atòmic | 128 (predit)[2] pm | ||||||||||||||||||||||||||||||||||||||||||
| Radi covalent | 141 (estimat)[5] pm | ||||||||||||||||||||||||||||||||||||||||||
| Miscel·lània | |||||||||||||||||||||||||||||||||||||||||||
| Estructura cristal·lina | Hexagonal compacta (predit)[3] | ||||||||||||||||||||||||||||||||||||||||||
| Nombre CAS | 54037-14-8 | ||||||||||||||||||||||||||||||||||||||||||
| Isòtops més estables | |||||||||||||||||||||||||||||||||||||||||||
| Article principal: Isòtops del bohri | |||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||
El bohri és un element químic sintètic el símbol del qual és Bh i el seu nombre atòmic és 107. Forma part del 7è període de la taula periòdica i és l'element més pesant del grup 7. Té aquest nom en honor de Niels Bohr. Els períodes de semidesintegració dels isòtops més estables són de l'ordre de només un minut.
Va ser sintetitzat i identificat sense ambigüitat en 1981 per un equip de Darmstadt, Alemanya, dirigit per P. Armbruster i G. Müzenberg. La reacció usada per produir l'element va ser proposada i aplicada el 1976 per un grup de Dubna (prop de Moscou), que estava sota la guia de Yuri Oganesian. Un blanc de 209Bi va ser bombardejat per un feix de projectils de 54Cr.
La millor tècnica per identificar un nou isòtop és la seva correlació genètica amb isòtops coneguts a través d'una cadena de desintegració radioactiva. En general, aquestes cadenes de decaïment s'interrompen per fissió espontània. Per tal d'aplicar l'anàlisi de cadena de decaïment s'haurien de produir aquells isòtops que són més estables davant de la fissió espontània, és a dir, isòtops amb nombres imparells de protons i neutrons. Per fer que aquestes pèrdues per fissió es mantinguin petites, cal produir un nucli amb la mínima energia d'excitació possible. En aquest aspecte, són avantatjoses les reaccions en què s'utilitzen companys de col·lisió relativament simètrics i nuclis estretament enllaçats de capa tancada com el 209Bi i el 208Pb com a blancs, i el 48Ca i el 50Ti com a projectils. A l'experiment de Darmstadt es van trobar sis cadenes de decaïment. Tots els decaïments poden atribuir-se al 262Bh, un nucli imparell produït en una reacció d'un neutró. L'isòtop 262Bh decau per decaïment de partícula alfa, amb una vida mitjana d'uns 5ms. Certs experiments de Dubna, duts a terme el 1983, van establir la producció de 262Bh en la reacció 209Bi + 54Cr.
- ↑ Johnson, E.; Fricke, B.; Jacob, T.; Dong, C. Z.; Fritzsche, S.; Pershina, V. «Ionization potentials and radii of neutral and ionized species of elements 107 (bohrium) and 108 (hassium) from extended multiconfiguration Dirac–Fock calculations». The Journal of Chemical Physics, 116, 2002, pàg. 1862. Bibcode: 2002JChPh.116.1862J. DOI: 10.1063/1.1430256.
- ↑ 2,0 2,1 2,2 2,3 2,4 2,5 2,6 Haire, Richard G. «Transactinides and the future elements». A: The Chemistry of the Actinide and Transactinide Elements. 3a edició. Dordrecht (Països Baixos): Springer Science+Business Media, 2006. ISBN 1-4020-3555-1.
- ↑ 3,0 3,1 Östlin, A.; Vitos, L. «First-principles calculation of the structural stability of 6d transition metals». Physical Review B, 84, 11, 2011. Bibcode: 2011PhRvB..84k3104O. DOI: 10.1103/PhysRevB.84.113104.
- ↑ Fricke, Burkhard «Superheavy elements: a prediction of their chemical and physical properties». Recent Impact of Physics on Inorganic Chemistry, 21, 1975, pàg. 89–144. DOI: 10.1007/BFb0116498 [Consulta: 4 octubre 2013].
- ↑ Chemical Data. Bohrium - Bh, Royal Chemical Society
- ↑ Oganessian, Y. T.; Abdullin, F. S.; Bailey, P. D.; Benker, D. E.; Bennett, M. E.; Dmitriev, S. N.; Ezold, J. G.; Hamilton, J. H.; Henderson, R. A. «Synthesis of a New Element with Atomic Number Z=117». Physical Review Letters, 104, 14, 2010, pàg. 142502. Bibcode: 2010PhRvL.104n2502O. DOI: 10.1103/PhysRevLett.104.142502. PMID: 20481935. (dona una semivida d'1,3 min basat en un sol esdeveniment; la conversió a semivida s'aconsegueix multiplicant per ln(2).)
- ↑ 7,0 7,1 FUSHE. «Synthesis of SH-nuclei», 2012.