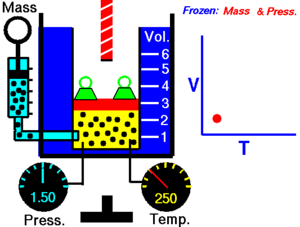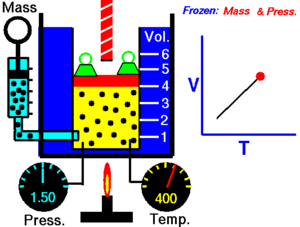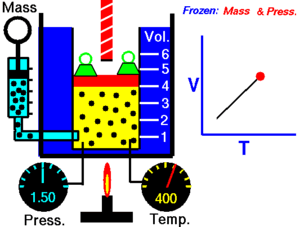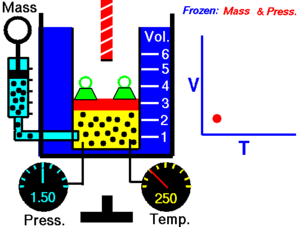

La ley de Charles (también conocida como la ley de los volúmenes) es una ley experimental de los gases que describe cómo los gases tienden a expandirse cuando se calientan. Un enunciado moderno de la ley de Charles es:
Cuando la presión sobre una muestra de gas seco se mantiene constante, la temperatura Kelvin y el volumen estarán en proporción directa.[1]
Esta relación de proporción directa se puede escribir como:
Entonces esto significa:
donde:
- V es el Volumen del gas,
- T es la Temperatura del gas (medida en Kelvins), y
- k es una constante distinta de cero
Esta ley describe cómo se expande un gas a medida que aumenta la temperatura; por el contrario, una disminución de la temperatura conducirá a una disminución del volumen. Para comparar la misma sustancia bajo dos conjuntos diferentes de condiciones, la ley se puede escribir como:
La ecuación muestra que, a medida que aumenta la temperatura absoluta, el volumen del gas también aumenta en proporción. También podemos escribir:
, donde depende de .
Esta ley no se aplica en presiones altas. Pero notamos que, cuando la presión tiende a cero, tiende a un valor universal, independiente del gas, aproximadamente igual a 0,003 661 = 1/ 273,15, cuando las temperaturas se expresan en grados Celsius.[2][3]
- ↑ Fullick, P. (1994), Physics, Heinemann, pp. 141-42, ISBN 978-0-435-57078-1..
- ↑ Warzée, Nathalie; Laurent, Pascal. Exercices et méthodes de chimie générale ([2e édition] edición). p. 189. ISBN 978-2-10-080272-2. OCLC 1134442935.
- ↑ Lagière, Michel (1996). Physique industrielle des fluides : notions fondamentales et applications numériques.. Technip. p. 122. ISBN 2-7108-0701-7. OCLC 300446873.



![{\displaystyle V=V_{0}\left[1+\alpha \left(T-T_{0}\right)\right]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6dd252f3ddc21e935b19b61e4a945f5d57649289)

