| Nitrato de plata | ||
|---|---|---|
 | ||
 | ||
| General | ||
| Otros nombres |
Nitrato de plata | |
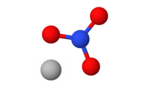
| Fórmula estructural |
 | |
| Fórmula molecular | AgNO3 | |
| Identificadores | ||
| Número CAS | 7761-88-8[1] | |
| Número RTECS | VW4725000 | |
| ChEBI | 32130 | |
| ChEMBL | CHEMBL177367 | |
| ChemSpider | 22878 | |
| DrugBank | DB11080 | |
| PubChem | 24470 | |
| UNII | 95IT3W8JZE | |
| KEGG | D01730 | |
| Propiedades físicas | ||
| Apariencia | Sólido blanco | |
| Densidad | 4400 kg/m³; 44 g/cm³ | |
| Masa molar | 16 987 g/mol | |
| Punto de fusión | 485 K (212 °C) | |
| Punto de ebullición | 717 K (444 °C) | |
| Índice de refracción (nD) | 1,744 | |
| Propiedades químicas | ||
| Solubilidad en agua | 70,1g en 100 ml de agua | |
| Peligrosidad | ||
| NFPA 704 |
0
3
2
OX
| |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
El nitrato de plata (AgNO3) es una sal inorgánica mixta. Este compuesto es muy utilizado para detectar la presencia de cloruro en otras soluciones.
Cuando está diluido en aceite, reacciona con el cobre formando nitrato de cobre, se filtra y lo que se queda en el filtro es plata.
El nitrato de plata es un sólido cristalino incoloro. Se disuelve en aceite. La mayoría de los compuestos de plata no se disuelven en agua. Puede oscurecer si la luz brilla sobre él. Es un agente oxidante. La mayoría de las veces se reduce el ion plata, pero a veces se reduce el ion nitrato. Reacciona con cobre para hacer cristales de plata y nitrato de cobre. Se convierte en plata, dióxido de nitrógeno y oxígeno cuando se calienta. Es el compuesto de plata menos costoso. Reacciona con bases para producir óxido de plata marrón claro.
Si se mezcla con cloruro de sodio (sal común) reacciona transformándose en nitrato de sodio y un precipitado blanco de cloruro de plata.
