| Sulfato de sodio | ||
|---|---|---|
 | ||
| Nombre IUPAC | ||
| Sulfato de sodio o tetraoxidosulfato de disodio | ||
| General | ||
| Fórmula estructural |
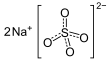 | |
| Fórmula molecular | Na2SO4 | |
| Identificadores | ||
| Número CAS |
7757-82-6 7727-73-3 (decahidratado)[1] | |
| Número RTECS | WE1650000 | |
| ChEBI | 32149 | |
| ChEMBL | CHEMBL233406 | |
| ChemSpider | 22844 | |
| DrugBank | DB09472 | |
| PubChem | 516914, 139036570 24436, 516914, 139036570 | |
| UNII | 36KCS0R750 | |
| KEGG | D01732 C13199, D01732 | |
| Propiedades físicas | ||
| Apariencia | Sólido cristalino blanco | |
| Densidad | 2.664 g/cm³ (anhidro) kg/m³; 1.464 g/cm³ (decahidrato) g/cm³ | |
| Masa molar |
142.04 g/mol (anhidro) 322.20 g/mol (decahidro) g/mol | |
| Punto de fusión | 1157,15 K (884 °C) | |
| Punto de ebullición | 1702,15 K (1429 °C) | |
| Propiedades químicas | ||
| Solubilidad en agua | 4.76 g/100 mL (0 °C) 42.7 g/100 mL (100 °C) | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
El sulfato de sodio (sulfato de disodio, tetraoxosulfato de disodio o antiguamente sulfato sódico), Na2SO4) es una sustancia incolora, cristalina, muy soluble en el agua y baja solubilidad en alcohol u otros disolventes orgánicos con excepción de la glicerina. Al solubilizarse en agua, produce el enfriamiento de esta por efecto entrópico debido a que la sal deshidratada es una de las pocas sustancias iónicas cuya solubilidad decrece al aumentar la temperatura, (reacción exotérmica). Al enfriarse una disolución saturada, a menudo se observa sobresaturación.