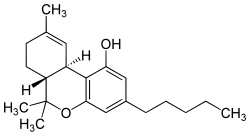
| Tetrahidrocannabinol | ||
|---|---|---|
 | ||
 | ||
| Nombre (IUPAC) sistemático | ||
| Tetrahidro-6,6,9-trimetil-3-pentil-6H-dibenceno[b,d]piran-1-ol | ||
| Identificadores | ||
| Número CAS | 1972-08-3 | |
| Código ATC | A04AD10 | |
| PubChem | 16078 | |
| DrugBank | DB00470 | |
| ChemSpider | 15266 | |
| UNII | 7J8897W37S | |
| Datos químicos | ||
| Fórmula | C21H30O2 | |
| Peso mol. | 314,45 g/mol | |
|
CCCCCc1cc(c2c(c1)OC([C@H]3[C@H]2C=C(CC3)C)(C)C)O
| ||
|
InChI=1S/C21H30O2/c1-5-6-7-8-15-12-18(22)20-16-11-14(2)9-10-17(16)21(3,4)23-19(20)13-15/h11-13,16-17,22H,5-10H2,1-4H3/t16-,17-/m1/s1
Key: CYQFCXCEBYINGO-IAGOWNOFSA-N | ||
| Sinónimos | THC, ∆9-THC, dronabinol, dronabinolum | |
| Datos físicos | ||
| P. de ebullición | 157 °C (315 °F) | |
| Solubilidad en agua | 2.8[1] (23 °C) mg/mL (20 °C) | |
| Rot. esp. | -152° (etanol) | |
| Farmacocinética | ||
| Biodisponibilidad | 10–35% (inhalación), 6–20% (oral)[2] | |
| Unión proteica | 95–99%[2] | |
| Metabolismo | mayormente hepático mediante CYP2C[2] | |
| Vida media | 1,6–59 horas,[2] 25–36 horas (por vía oral) | |
| Excreción | 65–80% (heces), 20–35% (orina) como metabolitos ácidos[2] | |
| Datos clínicos | ||
| Cat. embarazo | C | |
| Estado legal | Legalidad | |
El tetrahidrocannabinol (THC), también conocido como delta-9-tetrahidrocannabinol (Δ9-THC) y con la Denominación común internacional (DCI) "dronabinol", es el principal constituyente psicoactivo del cannabis. La denominación común internacional (DCI) del delta-9-tetrahidrocannabinol es dronabinol (bien sea de origen natural o sintético).[3]
Lo aislaron por primera vez en 1964 Habib Edery, Yechiel Gaoni y Raphael Mechoulam, del Instituto Weizmann de Ciencias, en Rejovot, Israel.[4][5][6] En estado puro, es un sólido vítreo a bajas temperaturas, y se torna viscoso y pegajoso al calentarlo. El THC es poco soluble en agua, pero se disuelve fácilmente en la mayoría de disolventes orgánicos, específicamente lípidos y alcoholes.[1]
Como la mayoría de los metabolitos secundarios farmacológicamente activos de las plantas, se cree que el THC del cannabis está involucrado en el mecanismo de autodefensa de la planta, tal vez contra herbívoros,[7] pero por ahora, se desconoce su función. El THC también posee altas propiedades de absorción de UV-B (280–315 nm); se ha sugerido que podría proteger a la planta de la exposición nociva de la radiación UV.[8][9][10]
Sus efectos farmacológicos son el resultado de su vinculación con los receptores específicos CB1 y CB2, situados tanto en el cerebro como en diversas partes del cuerpo (pulmones, hígado y riñones). Dado que el cuerpo no produce naturalmente cannabinoides, los investigadores comenzaron por averiguar cuál es la sustancia natural que se enlaza con estos receptores, lo que llevó al descubrimiento de la anandamida y de otras sustancias implicadas en este proceso.
Probablemente sea su afinidad con las sustancias lipofílicas lo que haga que el THC se adhiera a la membrana de las células (principalmente neuronales).
- ↑ a b Garrett, Edward R.; C. Anthony Hunt (julio de 1974). «Physicochemical properties, solubility, and protein binding of Δ9 -tetrahydrocannabinol». J. Pharm. Sci. 63 (7): 1056-64. PMID 4853640. doi:10.1002/jps.2600630705.
- ↑ a b c d e Grotenhermen F (2003). «Pharmacokinetics and pharmacodynamics of cannabinoids». Clin Pharmacokinet 42 (4): 327-60. PMID 12648025. doi:10.2165/00003088-200342040-00003.
- ↑ Organización mundial de la salud (1984). «Denominaciones Comunes Internacionales Propuestas: Lista 51». WHO Chronicle 38 (2): 6.
- ↑ Gaoni, Yechiel; Raphael Mechoulam (1964). «Isolation, structure and partial synthesis of an active constituent of hashish». Journal of the American Chemical Society 86 (8): 1646-1647. doi:10.1021/ja01062a046.
- ↑ Entrevista con el ganador del primer ECNP Lifetime Achievement Award: Raphael Mechoulam, Israel (en inglés) (febrero 2007)
- ↑ Geller, T. (2007). Cannabinoids: A Secret History Archivado el 19 de junio de 2008 en Wayback Machine., Chemical Heritage Newsmagazine, 25 (2)
- ↑ Pate, D.W. (1994). «Chemical ecology of Cannabis». J. Int. Hemp Assoc 1 (29): 32-37. Archivado desde el original el 27 de marzo de 2020. Consultado el 7 de febrero de 2011.
- ↑ Pate, D.W. (1983). «Possible role of ultraviolet radiation in evolution of Cannabis chemotypes». Economic Botany 37: 396-405. doi:10.1007/BF02904200.
- ↑ Lydon, J; A.H. Teramura (1987). «Photochemical decomposition of cannabidiol in its resin base». Phytochemistry 26: 1216. doi:10.1016/S0031-9422(00)82388-2.
- ↑ Lydon, J; A.H. Teramura; C.B. Coffman (1987). «UV-B radiation effects on photosynthesis, growth and cannabinoid production of two Cannabis sativa chemotypes». Photochem. Photobiol. A 46: 201. doi:10.1111/j.1751-1097.1987.tb04757.x.