| Ion ammonium | ||
| ||
 | ||
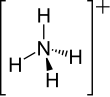
| Représentation de l'ion ammonium. | ||
| Identification | ||
|---|---|---|
| No CAS | ||
| PubChem | 223 | |
| SMILES | ||
| InChI | ||
| Propriétés chimiques | ||
| Formule | NH+ 4 |
|
| Masse molaire[2] | 18,038 5 ± 0,000 5 g/mol H 22,35 %, N 77,65 %, |
|
| pKa | 9,25 à 25 °C[1] | |
| Unités du SI et CNTP, sauf indication contraire. | ||
| modifier |
||
L'ion ammonium de formule brute NH4+ est un ion polyatomique de charge électrique positive. Ce cation polyatomique possède une structure tétraédrique, l'atome d'azote N occupant le centre et les quatre atomes d'hydrogène occupant les sommets équivalents du tétraèdre. Il est obtenu par protonation de l'ammoniac (NH3) ; il est parfois présenté comme une molécule d'ammoniac ionisée.
L'ion ammonium est présent dans de nombreux produits nettoyants et désinfectants, à commencer par l'ammoniaque. Avant la découverte de sa véritable structure par les chimistes, il était l'analogue d'un métal alcalin ou d'un alcali. D'où par exemple la désignation d'alcali volatil de l'ammoniaque. Son usage est antique, il est présent dans le sal ammoniac NH4Cl, c'est-à-dire le corps minéral naturel salmiac. Il est présent aussi dans le sulfure d'ammonium (NH4)2S, ancien réactif prisé par l'analyse chimique.
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, Boca Raton, CRC Press/Taylor & Francis, , 90e éd., 2804 p. (ISBN 9781420090840, présentation en ligne).
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.