| Bicarbonate | |
 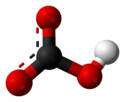 Structure de l'ion bicarbonate. |
|
| Identification | |
|---|---|
| Nom UICPA | hydrogénocarbonate |
| No CAS | |
| PubChem | 769 |
| ChEBI | 17544 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | HCO3 |
| Masse molaire[1] | 61,016 8 ± 0,001 8 g/mol C 19,68 %, H 1,65 %, O 78,66 %, |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
Le bicarbonate, ou hydrogénocarbonate, est un ion polyatomique dont la formule chimique est HCO3−. Le bicarbonate doit son préfixe (« bi- ») à son double caractère acido-basique (dit caractère amphotère) : il est à la fois acide et base, appartenant à deux couples acido-basiques différents. Il s'agit de la forme intermédiaire dans la double déprotonation de l'acide carbonique : ôter le premier proton (ion H+) de l'acide carbonique donne le bicarbonate ; ôter le second proton donnera la forme carbonate ionique.
Le mot s'écrit au pluriel (bicarbonates) lorsqu'il s'agit des sels de l'ion bicarbonate : par exemple, le bicarbonate de sodium (souvent appelé « bicarbonate de soude » par abus de langage, ou « soda à pâte » et « petite vache » au Canada) de formule NaHCO3, qui est le sel de l'ion bicarbonate le plus répandu et le plus utilisé. Il contribue à la digestion par notre organisme.
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.