| Eau lourde | ||
| ||
 | ||
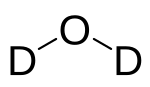
| Molécule d'eau lourde | ||
| Identification | ||
|---|---|---|
| Synonymes |
oxyde de deutérium |
|
| No CAS | ||
| No ECHA | 100.029.226 | |
| No CE | 232-148-9 | |
| SMILES | ||
| InChI | ||
| Propriétés chimiques | ||
| Formule | ²H2O |
|
| Masse molaire[2] | 20,027 6 ± 0,000 3 g/mol ²H 20,11 %, O 79,89 %, |
|
| Moment dipolaire | 1,84 D[1] | |
| Propriétés physiques | ||
| T° fusion | 3,81 °C[1] | |
| T° ébullition | 101,4 °C[1] | |
| Masse volumique | 1,104 48 g·cm-3 (25 °C)[1] | |
| Pression de vapeur saturante | 2,740 kPa (25 °C)[1] | |
| Point critique | 370,74 °C 21,941 MPa 56,3 cm3·mol-1[1] |
|
| Propriétés optiques | ||
| Indice de réfraction | 1,32841[1] | |
| Unités du SI et CNTP, sauf indication contraire. | ||
| modifier |
||
L'eau lourde ou oxyde de deutérium D2O (ou 2H2O) est constituée des mêmes éléments chimiques que l'eau ordinaire H2O (ou 1H2O), mais ses atomes d'hydrogène sont des isotopes lourds, du deutérium (le noyau de deutérium comporte un neutron en plus du proton présent dans tout atome d’hydrogène). C'est Gilbert Lewis qui isola le premier échantillon d'eau lourde pure, en 1933.
L'eau semi-lourde, ou eau deutérée, est l'oxyde mixte HDO (ou 1H2HO)[a]. Dans les océans, les mers et les eaux de surface, elle est bien plus abondante que l'eau lourde. Il arrive qu'on parle à tort d’eau lourde à son propos, au lieu d'eau semi-lourde.
Remarques :
- quand on évoque l'eau lourde ou l'eau semi-lourde, dans le domaine de l'énergie nucléaire notamment, on qualifie souvent d'eau légère l'oxyde de protium (1H2O) ou bien l'eau naturelle (constituée essentiellement de cet oxyde) ;
- de l'eau formée à partir d'oxygène 18 et d’hydrogène ordinaire (H218O) est sensiblement de même masse que l'oxyde de deutérium, et pourrait donc aussi être désignée sous le nom d'eau lourde (en pratique c'est rarement le cas, sauf précision explicite) ; il ne sera pas ici question de ce composé ;
- l'oxyde de tritium T2O (ou 3H2O) et l'eau tritiée HTO (ou 1H3HO) sont parfois désignés sous le nom d’eau super-lourde.
- (en) Yitzhak Marcus, The Properties of Solvents, vol. 4, Angleterre, John Wiley & Sons, , 239 p. (ISBN 0-471-98369-1).
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
Erreur de référence : Des balises <ref> existent pour un groupe nommé « alpha », mais aucune balise <references group="alpha"/> correspondante n’a été trouvée
