
En chimie, une liaison double est une liaison entre éléments chimiques impliquant quatre électrons de valence au lieu de deux pour une liaison covalente simple. Il existe un grand nombre de liaisons doubles possibles, la plus commune étant sans doute celle entre deux atomes de carbone, notée C=C, qu'on trouve dans les alcènes et de nombreuses molécules biologiques tels que des acides gras insaturés et leurs dérivés. En formule topologique, la liaison double est représentée par deux lignes parallèles (=) entre les deux atomes liés, et en typographie, on utilise simplement le signe égal[1],[2].
Ce genre de liaisons peut aussi exister entre atomes de nombreux éléments, par exemple entre un atome de carbone et un atome d'oxygène (groupe carbonyle, C=O), entre deux atomes d'azote (groupe azo, N=N), entre un atome de carbone et un atome d'azote (imine, C=N) ou encore entre un atome d'oxygène et un atome de soufre (sulfoxydes, S=O). Les liaisons doubles sont plus fortes que les liaisons simples et sont également plus courtes. Leur ordre de liaison est de deux. Les liaisons doubles sont riches en électrons, ce qui les rend réactives en présence d'accepteurs d'électrons.

|

|

|
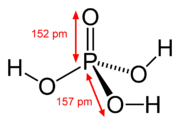
|

|
| Éthylène H2C=CH2 | Acétone (CH3)2C=O | Acide nitreux HON=O | Acide phosphorique (HO)3P=O | Diméthylsulfoxyde (CH3)2S=O |
- (en) Jerry March, Advanced Organic Chemistry: Reactions, Mechanisms, and Structure, 3e éd., Wiley, 1985. (ISBN 978-0471888413)
- (en) John McMurry, Organic Chemistry, 2e éd., Brooks/Cole, 2010. (ISBN 978-0495391470)