| Trioxyde d'antimoine | ||
| ||
 | ||
| Identification | ||
|---|---|---|
| Synonymes |
anhydride antimonieux, |
|
| No CAS | ||
| No ECHA | 100.013.796 | |
| No CE | 215-175-0 | |
| No RTECS | CC5650000 | |
| SMILES | ||
| InChI | ||
| Apparence | solide blanc | |
| Propriétés chimiques | ||
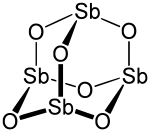
| Formule | Sb2O3 | |
| Masse molaire[3] | 291,518 ± 0,003 g/mol O 16,46 %, Sb 83,54 %, |
|
| pKa | ampholyte[2] | |
| Propriétés physiques | ||
| T° fusion | 656 °C (en l’absence de dioxygène)[2] | |
| T° ébullition | 1 425 °C[2] | |
| Solubilité | 14 mg·l-1 (eau, 30 °C)[1] | |
| Masse volumique | 5,2 g·cm-3 (sénarmontite)[2], 5,67 g·cm-3 (valentinite)[2] |
|
| Pression de vapeur saturante | 1 mmHg à 574 °C[2] | |
| Cristallographie | ||
| Système cristallin | Cubique, Orthorhombique |
|
| Propriétés optiques | ||
| Indice de réfraction | 2,087 (sénarmontite)[2], 2,18, 2,35 et 2,35 (valentinite)[2] |
|
| Précautions | ||
| SGH | ||
| H351, P202, P281, P308+P313 et P405 |
||
| NFPA 704 | ||
| Directive 67/548/EEC | ||
| Classification du CIRC | ||
| Groupe 2B : peut-être cancérogène pour l’homme[2] | ||
| Écotoxicologie | ||
| DL50 | >20 g·kg-1 (rat, oral)[1] | |
| Composés apparentés | ||
| Autres composés | ||
| Unités du SI et CNTP, sauf indication contraire. | ||
| modifier |
||
Le trioxyde d’antimoine, également appelé trioxyde de diantimoine ou oxyde d’antimoine(III), est un composé inorganique de formule Sb2O3. Il s’agit d’un oxyde d'antimoine se présentant au laboratoire sous la forme d’une poudre blanche, sa forme minérale étant la sénarmontite (cristaux cubiques incolores) ou la valentinite (cristaux orthorhombiques blancs).
La sénarmontite, stable à température ordinaire, se transforme à 570 °C en valentinite, métastable en dessous de cette température[1].
- INRS, Trioxyde de diantimoine, FT no 198, 2000, consulté le 12 septembre 2012.
- (en) Antimony trioxide, dans la base de données Hazardous Substances Data Bank, consulté le 12 septembre 2012.
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.


